Rutherford hizo pasar un haz de partículas a (cargadas positivamente y que eran emitidas por un elemento radiactivo como el polonio, Po) por una rendija, haciéndolo incidir en una lámina de oro muy delgada, de unos 400 átomos de oro de espesor. Los resultados del experimento se visualizaban en una placa fotográfica. La gran mayoría de las partículas a no sufrían desviación alguna en su trayectoria. Algunas eran desviadas un cierto ángulo y otras, muy pocas, eran fuertemente desviadas al atravesar la lámina de oro. De los resultados obtenidos en este experimento Rutherford propuso que el átomo era esférico y en su centro se concentraba toda la carga positiva y casi la totalidad de la masa atómica. Alrededor de dicho centro o núcleo giraban los electrones, de manera que el número de electrones era igual al de protones. El núcleo ocupaba, según Rutherford, un espacio muy pequeño comparado con el volumen total ocupado por el átomo, de tal suerte que éste podría considerarse prácticamente hueco. Ello explicaría que la mayoría de las partículas a no se desviaran al atravesar la lámina de oro mientras que las que sufrían desviación eran aquellas que se aproximaban al núcleo de los átomos de oro. Sin embargo, este modelo era inconsistente con los postulados de la Física Clásica: toda partícula en movimiento emite energía, por lo que la propuesta de Rutherford supondría la existencia de átomos inestables, que emitirían una radiación continua en todas las longitudes de onda.
En 1885, Balmer había demostrado que los átomos cuando emiten radiación lo hacen de forma discontinua, es decir, se obtiene un espectro discreto. Cualquier modelo atómico tendría que explicar este hecho, y el de Rutherford no estaba en concordancia con ello
. El modelo de Bohr constaba de una serie de postulados:
- El átomo está constituido por una zona central o núcleo donde se concentra toda la masa y la carga positiva del átomo.
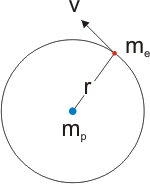
- Los electrones giran entorno al núcleo en órbitas circulares estacionarias, de modo que Fc = Fa. (Fc = fuerza centrífuga; Fa = fuerza centrípeta).
- Los electrones sólo se mueven en órbitas estables, que son aquellas cuyo momento angular presenta un valor que es un múltiplo entero de la constante de Plank:
H = mvr = nh/2π, donde n = 1, 2, 3,... (n, número cuántico).
No hay comentarios:
Publicar un comentario